QUE SON LOS ALCOHOLES
se denomina alcohol (del árabe al-kuḥl الكحول, o al-ghawl الغول, "el espíritu", "toda sustancia pulverizada", "líquido destilado") a aquellos compuestos químicos orgánicos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno enlazado de forma covalente a un átomo de carbono. Además, este carbono debe estar saturado, es decir, debe tener solo enlaces simples a sendos átomos, esto diferencia a los alcoholes de los fenoles
Si contienen varios grupos hidroxilos se denominan polialcoholes. Los alcoholes pueden ser primarios, secundarios o terciarios, en función del número de átomos de hidrógeno sustituidos en el átomo de carbono al que se encuentran enlazado el grupo hidroxilo.
Propiedades químicas de los alcoholes
Los alcoholes pueden comportarse como ácidos o bases gracias a que el grupo funcional es similar al agua, por lo que se establece un dipolo muy parecido al que presenta la molécula de agua.
Por un lado, si se enfrenta un alcohol con una base fuerte o con un hidruro de metal alcalino se forma el grupo alcoxi, en donde el grupo hidroxilo se desprotona dejando al oxígeno con carga negativa. La acidez del grupo hidroxilo es similar a la del agua, aunque depende fundamentalmente del impedimento estérico y del efecto inductivo. Si un hidroxilo se encuentra enlazado a un carbono terciario, éste será menos ácido que si se encontrase enlazado a un carbono secundario, y a su vez éste sería menos ácido que si estuviese enlazado a un carbono primario, ya que el impedimento estérico impide que la molécula se solvate de manera efectiva. El efecto inductivo aumenta la acidez del alcohol si la molécula posee un gran número de átomos electronegativos unidos a carbonos adyacentes (los átomos electronegativos ayudan a estabilizar la carga negativa del oxígeno por atracción electrostática).
Por otro lado, el oxígeno posee 2 pares electrónicos no compartidos por lo que el hidroxilo podría protonarse, aunque en la práctica esto conduce a una base muy débil, por lo que para que este proceso ocurra, es necesario enfrentar al alcohol con un ácido muy fuerte.
Nomenclatura
Es común que los alcoholes se nombren usando la palabra alcohol como nombre, y con el "apellido" del grupo correspondiente a los alcanos básicos que le dan lugar, esta nomenclatura se ilustra a continuación.

También existe la denominación de la IUPAC (International Union of Pure and Applied Chemistry) que resulta necesaria para los alcoholes con estructura mas compleja.
Según la IUPAC para nombrar los alcoholes se utiliza la terminación -ol al final de la nomenclatura raíz del homólogo correspondiente de los alcanos. Por ejemplo:
| CH4 | CH3OH |
| Metano | Metanol |
| CH3CH3 | CH3CH2OH |
| Etano | Etanol |
USOS DE LOS ALCOHOLES EN LA INDUSTRIA
Durante la destilación del petróleo se recuperan ciertas cantidades de mezclas de alcoholes en el rango C3 hasta C5, que se utilizan principalmente como materias primas para la producción de otros compuestos.
Se obtienen alcoholes diversos también como subproductos de procesos de síntesis de otros compuestos orgánicos.
Cantidades importantes de glicerina, un alcohol con tres grupos hidroxilo, se obtienen en la saponificación de las grasas naturales para la producción de jabón. La glicerina se usa extensamente en la preparación de cremas y productos cosméticos.
Durante la fermentación natural de soluciones dulces, (melazas o azúcares en agua, jugo de frutas dulces, etc.) se puede obtener una disolución de etanol hasta del 12% de concentración, que luego puede ser concentrada por destilación directa hasta el 95%. En condiciones especiales o con el uso de sales deshidratadoras puede incluso aumentarse la concentración hasta obtener etanol técnicamente puro.
Se obtienen alcoholes diversos también como subproductos de procesos de síntesis de otros compuestos orgánicos.
Cantidades importantes de glicerina, un alcohol con tres grupos hidroxilo, se obtienen en la saponificación de las grasas naturales para la producción de jabón. La glicerina se usa extensamente en la preparación de cremas y productos cosméticos.
Durante la fermentación natural de soluciones dulces, (melazas o azúcares en agua, jugo de frutas dulces, etc.) se puede obtener una disolución de etanol hasta del 12% de concentración, que luego puede ser concentrada por destilación directa hasta el 95%. En condiciones especiales o con el uso de sales deshidratadoras puede incluso aumentarse la concentración hasta obtener etanol técnicamente puro.
Esta nomenclatura de la IUPAC es particularmente útil para los alcoholes mas complejos, así tenemos que la posición del grupo hidroxilo (-OH) se señala con un número, este número corresponde al carbono de la cadena recta mas larga encontrada, y contado a partir del extremo mas cercano al carbono que tiene el grupo hidroxilo.
En química orgánica y bioquímica, un éter es un grupo funcional del tipo R-O-R', en donde R y R' son grupos alquilo, estando el átomo de oxígeno unido y se emplean pasos intermedios:
- ROH + HOR' → ROR' + H2O
Normalmente se emplea el alcóxido, RO-, del alcohol ROH, obtenido al hacer reaccionar al alcohol con una base fuerte. El alcóxido puede reaccionar con algún compuesto R'X, en donde X es un buen grupo saliente, como por ejemplo yoduro o bromuro. R'X también se puede obtener a partir de un alcohol R'OH.
- RO- + R'X → ROR' + X-
Al igual que los ésteres, no forman puentes de hidrógeno. Presentan una alta hidrofobicidad, y no tienden a ser hidrolizados. Los éteres suelen ser utilizados como disolventes orgánicos.
Suelen ser bastante estables, no reaccionan fácilmente, y es difícil que se rompa el enlace carbono-oxígeno. Normalmente se emplea, para romperlo, un ácido fuerte como el ácido yodhídrico, calentando, obteniéndose dos halogenuros, o un alcohol y un halogenuro. Una excepción son los oxiranos (o epóxidos), en donde el éter forma parte de un ciclo de tres átomos, muy tensionado, por lo que reacciona fácilmente de distintas formas.
El enlace entre el átomo de oxígeno y los dos carbonos se forma a partir de los correspondientes orbitales híbridos sp³. En el átomo de oxígeno quedan dos pares de electrones no enlazantes.
Los dos pares de electrones no enlazantes del oxígeno pueden interaccionar con otros átomos, actuando de esta forma los éteres como ligandos, formando complejos. Un ejemplo importante es el de loséteres corona, que pueden interaccionar selectivamente con cationes de elementos alcalinos o, en menor medida, alcalinotérreos.

USOS DEL ETER
El éter isopropílico es un líquido incoloro con un olor dulce distintivo. Es una molécula orgánica o basada en el carbono y es un éter. Esto significa que hay un átomo de oxígeno central que mantiene juntos a los otros dos grupos de átomos. El átomo de oxígeno forma enlaces con ambos grupos. En la molécula de éter isopropílico, los dos grupos que se sujetan al átomo de oxígeno son los dos grupos isopropilos. El éter isopropílico suele llamarse diisopropil éter, propano de óxido o 2-isopropoxipropano. El éter isopropílico tiene un sinfín de aplicaciones en industrias y laboratorios químicos
Uso industrial
Muchos tipos de industrias utilizan éter isopropílico. Es un componente de muchas pinturas y barnices, lacas. Los fabricantes de productos químicos también lo utilizan para sintetizar y analizar los productos químicos. Los químicos industriales y de investigación utilizan éter isopropílico. La industria de combustible también lo utiliza. El éter isopropílico es una alternativa más barata al etilo y al petróleo en extracciones de grasas. También es conveniente y ahorra tiempo.
Propiedades Físicas:
Sus puntos de ebullición son menores que los alcoholes que lo formaron pero son similares a los alcanos de pesos moleculares semejantes. A diferencia de los alcoholes no establecen uniones puente de hidrógeno y esto hace que sus puntos de ebullición sean significativamente menores.
Son algo solubles en agua. Son incoloros y al igual que los ésteres tienen olores agradables. El más pequeño es gaseoso, los siguientes líquidos y los más pesados sólidos.
Propiedades Químicas:
No tienen hidrógenos activos como en los casos de los alcoholes o ácidos. Por este motivo son inertes ante metales como el sodio o potasio o litio. Necesitan del calor para descomponerse y ahí si poder reaccionar con algunos metales.
CH3 — CH2 –O–(CH2)2— CH3 + 2 Na —–> CH3 — CH2 O Na + CH3 — CH2 — CH2 Na
Etano oxi Propano Etanolato de sodio sodio propilo
ESTERES
Los Ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorgánicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.1
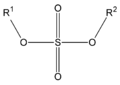
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
| Éster
(éster de ácido carboxílico)
| Éster carbónico
(éster de ácido carbónico)
| Éster fosfórico
(triéster de ácido fosfórico)
| Éster sulfúrico
(diéster de ácido sulfúrico)
|
|---|---|---|---|
 |  |  |  |
El salicilato de metilo ó aceite de bétula ó aceite de gaultería ó aceite de Wintergreen es un líquido incoloro, amarillo o rojizo que tiene el olor y sabor de la gaultería. Comercialmente se emplea en perfumes y como saborizante en caramelos. Se emplea como ingrediente analgésico en linimentos y para contrairritación cutánea ya que al frotarlo en la piel posee la propiedad común de penetrar a través de la superficie. Con esto ocurre la hidrólisis, liberando ácido salicílico, el cual alivia el dolor. Su aplicación excesiva ha producido fallecimientos. Se ha clasificado como veneno pediátrico y debe prescribirse el uso en terapéutica


Éster fenilmetílico
El benzoato de bencilo (Acido benzoico, éster fenilmetílico) es muy empleado en el tratamiento de la sarna y también es útil en el tratamiento de la pediculosis (afección cutánea producida por piojos). No debe aplicarse sobre piel inflamada, irritada con quemaduras, no debe usarse en mucosas y cara.

Propiedades físicas:
Los que son de bajo peso molecular son líquidos volátiles de olor agradable. Son las responsables de los olores de ciertas frutas.
Los ésteres superiores son sólidos cristalinos, inodoros. Solubles en solventes orgánicos e insolubles en agua. Son menos densos que el agua.
Propiedades Químicas:
Hidrólisis ácida:
Ante el calor, se descomponen regenerando el alcohol y el ácido correspondiente. Se usa un exceso de agua para inclinar esta vez la reacción hacia la derecha. Como se menciono es la inversa de la esterificación.
Hidrólisis en medio alcalino:
En este caso se usan hidróxidos fuertes para atacar al éster, y de esta manera regenerar el alcohol. Y se forma la sal del ácido orgánico.
BENEFICIOS DE LOS ALCOHOLES EN LA INDUSTRIA
Los alcoholes se utilizan como productos químicos intermedios ydisolventes en las industrias de textiles, colorantes, productosquímicos, detergentes, perfumes, alimentos, bebidas, cosméticos,pinturas y barnices. Algunos compuestos se utilizan también en lades-naturalización del alcohol, en productos de limpieza, aceitesy tintas de secado rápido, anticongelantes, agentes espumígenosy en la flotación de minerales
*El n-propanol es un disolvente utilizado en lacas, cosméticos,lociones dentales, tintas de impresión, lentes de contacto ylíquidos de frenos. También sirve como antiséptico, aromatizantesintético de bebidas no alcohólicas y alimentos, producto químicointermedio y desinfectante
*El n-butanol se emplea como disolvente de pinturas, lacas,barnices, resinas naturales y sintéticas, gomas, aceites vegetales,tintes y alcaloides. Se utiliza como sustancia intermedia en lafabricación de productos químicos y farmacéuticos, y en lasindustrias de cuero artificial, textiles, gafas de seguridad, pastasde caucho, barnices de laca, impermeables, películas fotográficasy perfumes
*El etanol es la materia prima de numerosos productos, comoacetaldehído, éter etílico y cloroetano. Se utiliza como anticongelante, aditivo alimentario y medio de crecimiento de levaduras,en la fabricación de revestimientos de superficie y en la preparación de mezclas de gasolina y alcohol etílico
DESVENTAJAS DE LOS ALCOHOLES EN LA INDUSTRIA
*El alcohol metílico tiene propiedades tóxicas que puedenhacerse evidentes tanto por exposición aguda como crónica. Losalcohólicos que ingieren este líquido o los trabajadores queinhalan sus vapores pueden sufrir lesiones. En experimentos conanimales se ha demostrado que el alcohol metílico puede penetrar en la piel en cantidad suficiente como para causar una intoxicación mortal.En casos de intoxicación grave, generalmente por ingestión, elalcohol metílico actúa de forma específica en el nervio óptico,causando ceguera como resultado de la degeneración del nervioóptico, acompañada de cambios degenerativos en las célulasganglionares de la retina y trastornos circulatorios en la coroides.La ambliopía es normalmente bilateral y puede aparecer pocashoras después de la ingestión
*EtanolUn riesgo industrial frecuente es la exposición a vapores enla proximidad de un proceso en el que se utiliza alcohol etílico.La exposición prolongada a concentraciones superiores a5.000 ppm causa irritación de los ojos y la nariz, cefalea, sopor,fatiga y narcosis
*EtanolUn riesgo industrial frecuente es la exposición a vapores enla proximidad de un proceso en el que se utiliza alcohol etílico.La exposición prolongada a concentraciones superiores a5.000 ppm causa irritación de los ojos y la nariz, cefalea, sopor,fatiga y narcosis
*n-Propanol No se han notificado casos de intoxicación relacionados con eluso industrial de n-propanol. Para los animales de experimentaciónes moderadamente tóxico cuando se administra por vías respiratoria, oral o percutánea. Irrita las mucosas y deprime el sistemanervioso central. Cuando se inhala, produce una leve irritacióndel aparato respiratorio y ataxia. Es algo más tóxico que elalcohol isopropílico, pero aparentemente provoca los mismos efectos biológico

No hay comentarios:
Publicar un comentario